Jednym z ważnych pytań w badaniu układów termodynamicznych w fizyce jest pytanie, czy układ ten może wykonać jakąś użyteczną pracę. Ściśle związane z pojęciem pracy jest pojęcie energii wewnętrznej. W tym artykule zastanowimy się, jaka jest energia wewnętrzna gazu doskonałego i podamy wzory do jej obliczenia.
Gaz idealny
O gazie, jako stanie skupienia, który nie wywiera na niego żadnej siły sprężystej pod wpływem czynników zewnętrznych, a co za tym idzie nie zachowuje objętości i kształtu, to wie każdy uczeń. Koncepcja gazu doskonałego dla wielu pozostaje niezrozumiała i niejasna. Wyjaśnijmy to.
Gaz doskonały to każdy gaz, który spełnia następujące dwa ważne warunki:
- Cząsteczki, z których się składa, nie mają rozmiaru. Mają rozmiar, ale jest tak mały w porównaniu do odległości między nimi, że można go zignorować we wszystkich obliczeniach matematycznych.
- Cząstki nie oddziałują ze sobą za pomocą sił lub sił van der Waalsainna natura. W rzeczywistości we wszystkich rzeczywistych gazach takie oddziaływanie występuje, ale jego energia jest znikoma w porównaniu do średniej energii cząstek kinetycznych.
Opisane warunki spełniają prawie wszystkie gazy rzeczywiste, których temperatury przekraczają 300 K, a ciśnienia nie przekraczają jednej atmosfery. Przy zbyt wysokich ciśnieniach i niskich temperaturach obserwuje się odchylenie gazów od zachowania idealnego. W tym przypadku mówi się o gazach rzeczywistych. Opisuje je równanie van der Waalsa.
Pojęcie energii wewnętrznej gazu doskonałego
Zgodnie z definicją, energia wewnętrzna systemu jest sumą energii kinetycznej i potencjalnej zawartej w tym systemie. Jeśli ta koncepcja zostanie zastosowana do gazu doskonałego, potencjalny składnik należy odrzucić. Rzeczywiście, ponieważ cząstki gazu doskonałego nie oddziałują ze sobą, można je uznać za poruszające się swobodnie w próżni absolutnej. Aby wyodrębnić jedną cząstkę z badanego układu, nie jest konieczne wykonywanie pracy przeciwko wewnętrznym siłom interakcji, ponieważ siły te nie istnieją.
Tak więc energia wewnętrzna gazu doskonałego zawsze pokrywa się z jego energią kinetyczną. Ta z kolei jest jednoznacznie określona przez masę molową cząstek układu, ich liczbę, a także średnią prędkość ruchu translacyjnego i obrotowego. Szybkość ruchu zależy od temperatury. Wzrost temperatury prowadzi do wzrostu energii wewnętrznej i odwrotnie.
Formuła dlaenergia wewnętrzna
Oznacz energię wewnętrzną układu gazu doskonałego literą U. Zgodnie z termodynamiką jest ona definiowana jako różnica między entalpią H układu a iloczynem ciśnienia i objętości, czyli:
U=H - pV.
W powyższym akapicie dowiedzieliśmy się, że wartość U odpowiada całkowitej energii kinetycznej Ek wszystkich cząstek gazu:
U=Ek.
Z mechaniki statystycznej, w ramach molekularnej teorii kinetycznej (MKT) gazu doskonałego, wynika, że średnia energia kinetyczna jednej cząstki Ek1 jest równa następująca wartość:
Ek1=z/2kBT.
Tu kB i T - stała i temperatura Boltzmanna, z - liczba stopni swobody. Całkowitą energię kinetyczną układu Ek można uzyskać mnożąc Ek1 przez liczbę cząstek N w układzie:
Ek=NEk1=z/2NkBT.
W ten sposób otrzymaliśmy wzór na energię wewnętrzną gazu doskonałego, zapisany w formie ogólnej w postaci temperatury bezwzględnej i liczby cząstek w układzie zamkniętym:
U=z/2NkBT.
Gaz jednoatomowy i wieloatomowy
Wzór na U zapisany w poprzednim akapicie artykułu jest niewygodny w praktycznym zastosowaniu, ponieważ trudno jest określić liczbę cząstek N. Jeśli jednak weźmiemy pod uwagę definicję ilości substancji n, to wyrażenie to można przepisać w wygodniejszej postaci:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Liczba stopni swobody z zależy od geometrii cząstek tworzących gaz. Zatem dla gazu jednoatomowego z=3, ponieważ atom może poruszać się niezależnie tylko w trzech kierunkach przestrzeni. Jeśli gaz jest dwuatomowy, to z=5, ponieważ do trzech translacyjnych stopni swobody dodaje się jeszcze dwa obrotowe stopnie swobody. Wreszcie, dla dowolnego innego gazu wieloatomowego, z=6 (3 translacyjne i 3 obrotowe stopnie swobody). Mając to na uwadze, możemy zapisać w następującej formie wzory na energię wewnętrzną gazu doskonałego jednoatomowego, dwuatomowego i wieloatomowego:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Przykład zadania do określenia energii wewnętrznej
100-litrowa butla zawiera czysty wodór pod ciśnieniem 3 atmosfer. Zakładając, że wodór jest gazem idealnym w danych warunkach, konieczne jest określenie jego energii wewnętrznej.

Powyższe wzory na U zawierają ilość substancji i temperaturę gazu. W stanie problemu absolutnie nic nie mówi się o tych ilościach. Aby rozwiązać problem, należy przypomnieć uniwersalne równanie Clapeyrona-Mendeleeva. Ma wygląd pokazany na rysunku.
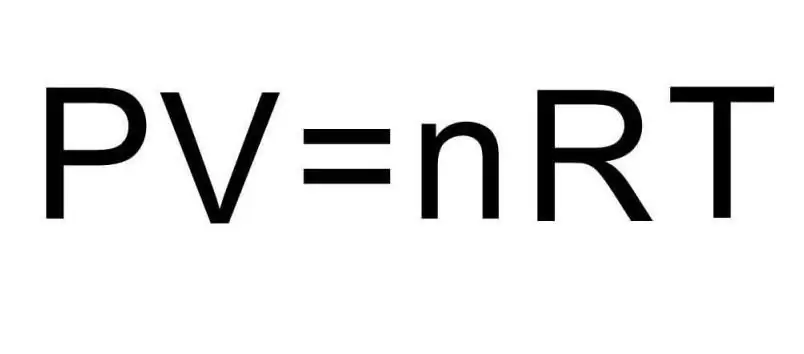
Ponieważ wodór H2 jest cząsteczką dwuatomową, wzór na energię wewnętrzną to:
UH2=5/2nRT.
Porównując oba wyrażenia, dochodzimy do ostatecznego wzoru na rozwiązanie problemu:
UH2=5/2PV.
Pozostaje przekonwertować jednostki ciśnienia i objętości ze stanu do układu jednostek SI, zamienić odpowiednie wartości we wzorze na UH2i uzyskać odpowiedź: UH2 ≈ 76 kJ.






