Przejście adiabatyczne między dwoma stanami w gazach nie jest jednym z izoprocesów, jednak odgrywa ważną rolę nie tylko w różnych procesach technologicznych, ale także w przyrodzie. W tym artykule rozważymy, czym jest ten proces, a także podamy równania adiabatyczne dla gazu doskonałego.
Gaz idealny w skrócie
Gaz doskonały to taki, w którym nie ma interakcji między jego cząsteczkami, a ich rozmiary są równe zeru. Oczywiście w naturze nie ma stuprocentowych gazów idealnych, ponieważ wszystkie składają się z cząsteczek i atomów o wielkości, które zawsze oddziałują ze sobą, przynajmniej za pomocą sił van der Waalsa. Niemniej jednak opisany model jest często wykonywany z wystarczającą dokładnością do rozwiązywania praktycznych problemów dla wielu rzeczywistych gazów.
Głównym równaniem gazu doskonałego jest prawo Clapeyrona-Mendeleeva. Jest napisany w następującej formie:
PV=nRT.
To równanie określa bezpośrednią proporcjonalność między produktemciśnienie P na objętość V i ilość substancji n na temperaturę bezwzględną T. Wartość R jest stałą gazową, która pełni rolę współczynnika proporcjonalności.
Co to jest proces adiabatyczny?
Proces adiabatyczny to przejście między stanami systemu gazowego, w którym nie następuje wymiana energii z otoczeniem. W tym przypadku zmieniają się wszystkie trzy termodynamiczne charakterystyki układu (P, V, T), a ilość substancji n pozostaje stała.
Rozróżnij adiabatyczną ekspansję i kurczliwość. Oba procesy zachodzą tylko dzięki wewnętrznej energii systemu. Tak więc w wyniku rozszerzania ciśnienie, a zwłaszcza temperatura układu, drastycznie spadają. Odwrotnie, kompresja adiabatyczna powoduje dodatni skok temperatury i ciśnienia.
Aby zapobiec wymianie ciepła między otoczeniem a systemem, ten ostatni musi mieć izolowane termicznie ściany. Ponadto skrócenie czasu procesu znacznie ogranicza przepływ ciepła do i z układu.
Równania Poissona dla procesu adiabatycznego

Pierwsza zasada termodynamiki jest napisana w następujący sposób:
Q=ΔU + A.
Innymi słowy, ciepło Q przekazywane do systemu jest wykorzystywane do wykonania pracy A przez system i do zwiększenia jego energii wewnętrznej ΔU. Do zapisania równania adiabatycznego należy wpisać Q=0, co odpowiada definicji badanego procesu. Otrzymujemy:
ΔU=-A.
Z izochoriąw idealnym gazie całe ciepło idzie na zwiększenie energii wewnętrznej. Ten fakt pozwala nam napisać równość:
ΔU=CVΔT.
Gdzie CV jest izochoryczną pojemnością cieplną. Z kolei praca A jest obliczana w następujący sposób:
A=PdV.
Gdzie dV oznacza małą zmianę głośności.
Oprócz równania Clapeyrona-Mendeleeva, dla gazu doskonałego obowiązuje następujące równanie:
CP- CV=R.
Gdzie CP jest izobaryczną pojemnością cieplną, która jest zawsze większa niż izochoryczna, ponieważ uwzględnia straty gazu spowodowane rozszerzaniem.
Analizując powyższe równania i całkując po temperaturze i objętości, otrzymujemy następujące równanie adiabatyczne:
TVγ-1=const.
Tutaj γ jest indeksem adiabatycznym. Jest równy stosunkowi izobarycznej pojemności cieplnej do izochorycznej. Ta równość nazywana jest równaniem Poissona dla procesu adiabatycznego. Stosując prawo Clapeyrona-Mendeleeva, możesz napisać jeszcze dwa podobne wyrażenia, tylko poprzez parametry P-T i P-V:
TPγ/(γ-1)=const;
PVγ=const.
Wykres adiabatyczny można przedstawić w różnych osiach. Poniżej jest pokazany w osiach P-V.
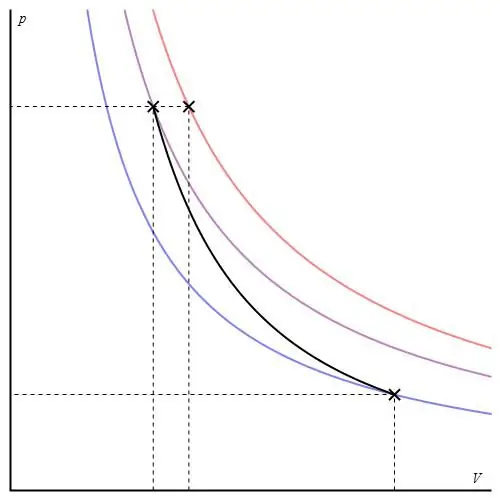
Kolorowe linie na wykresie odpowiadają izotermom, czarna krzywa to adiabat. Jak widać, adiabat zachowuje się ostrzej niż którakolwiek z izoterm. Łatwo to wytłumaczyć: dla izotermy ciśnienie zmienia się z powrotemproporcjonalna do objętości, ale w przypadku izobaty ciśnienie zmienia się szybciej, ponieważ wykładnik wynosi γ>1 dla dowolnego systemu gazowego.
Przykładowy problem
W naturze, na obszarach górskich, gdy masa powietrza przemieszcza się w górę zbocza, jego ciśnienie spada, zwiększa swoją objętość i ochładza się. Ten adiabatyczny proces obniża punkt rosy i wytwarza opady w stanie ciekłym i stałym.

Proponuje się rozwiązanie następującego problemu: w procesie podnoszenia masy powietrza wzdłuż zbocza góry ciśnienie spadło o 30% w porównaniu z ciśnieniem u podnóża. Jaka byłaby jego temperatura, gdyby u stóp wynosiła 25 oC?
Aby rozwiązać problem, użyj następującego równania adiabatycznego:
TPγ/(γ-1)=const.
Lepiej napisać to w tej formie:
T2/T1=(P2/P 1)(γ-1)/γ.
Jeżeli P1 zostanie przyjęte jako 1 atmosfera, wówczas P2 będzie równe 0,7 atmosfery. W przypadku powietrza wskaźnik adiabatyczny wynosi 1,4, ponieważ można go uznać za dwuatomowy gaz doskonały. Wartość temperatury T1 wynosi 298,15 K. Podstawiając wszystkie te liczby do powyższego wyrażenia, otrzymujemy T2=269,26 K, co odpowiada - 3, 9 oC.






