Znajomość definicji w fizyce jest kluczowym czynnikiem dla pomyślnego rozwiązywania różnych problemów fizycznych. W artykule rozważymy, co oznaczają procesy izobaryczne, izochoryczne, izotermiczne i adiabatyczne dla idealnego systemu gazowego.
Gaz idealny i jego równanie
Zanim przejdziemy do opisu procesów izobarycznych, izochorycznych i izotermicznych, zastanówmy się, czym jest gaz doskonały. Zgodnie z tą definicją w fizyce rozważają system składający się z ogromnej liczby bezwymiarowych i nieoddziałujących cząstek, które poruszają się z dużą prędkością we wszystkich kierunkach. W rzeczywistości mówimy o stanie skupienia gazowego materii, w którym odległości między atomami i cząsteczkami znacznie przekraczają ich rozmiary i w którym energia potencjalna oddziaływania cząstek jest pomijana ze względu na jej małość w porównaniu z energią kinetyczną.
Stan gazu doskonałego to suma jego parametrów termodynamicznych. Najważniejsze z nich to temperatura, objętość i ciśnienie. Oznaczmy je odpowiednio literami T, V i P. W latach 30. XIX wiekuClapeyron (francuski naukowiec) najpierw spisał równanie, które łączy wskazane parametry termodynamiczne w ramach jednej równości. Wygląda to tak:
PV=nRT,
gdzie n i R są odpowiednio ilością substancji i stałą gazową.
Co to są izoprocesy w gazach?
Jak wielu zauważyło, procesy izobaryczne, izochoryczne i izotermiczne używają w swoich nazwach tego samego przedrostka „iso”. Oznacza to równość jednego parametru termodynamicznego podczas przejścia całego procesu, podczas gdy pozostałe parametry ulegają zmianie. Na przykład proces izotermiczny wskazuje, że w rezultacie temperatura bezwzględna systemu jest utrzymywana na stałym poziomie, podczas gdy proces izochoryczny wskazuje na stałą objętość.
Izoprocesy są wygodne w badaniu, ponieważ ustalenie jednego z parametrów termodynamicznych prowadzi do uproszczenia ogólnego równania stanu gazu. Należy zauważyć, że prawa gazowe dla wszystkich tych izoprocesów zostały odkryte eksperymentalnie. Ich analiza pozwoliła Clapeyronowi uzyskać zredukowane równanie uniwersalne.
Procesy izobaryczne, izochoryczne i izotermiczne
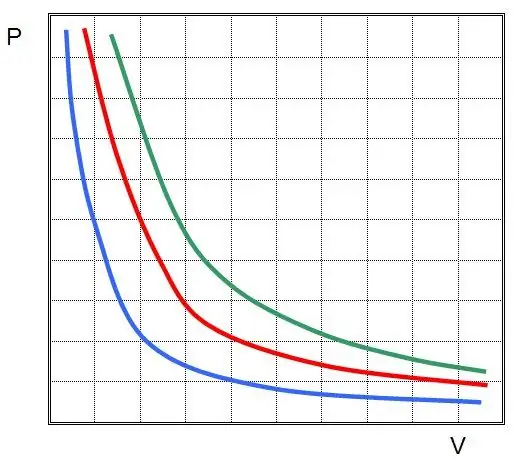
Pierwsze prawo zostało odkryte dla procesu izotermicznego w gazie doskonałym. Teraz nazywa się to prawem Boyle-Mariotte. Ponieważ T się nie zmienia, równanie stanu implikuje równość:
PV=const.
Innymi słowy, każda zmiana ciśnienia w układzie prowadzi do odwrotnie proporcjonalnej zmiany jego objętości, jeśli temperatura gazu jest utrzymywana na stałym poziomie. Wykres funkcji P(V) tohiperbola.
Proces izobaryczny - jest to zmiana stanu układu, w którym ciśnienie pozostaje stałe. Po ustaleniu wartości P w równaniu Clapeyrona otrzymujemy następujące prawo:
V/T=const.
Ta równość nosi imię francuskiego fizyka Jacquesa Charlesa, który otrzymał ją pod koniec XVIII wieku. Isobar (graficzna reprezentacja funkcji V(T)) wygląda jak linia prosta. Im większe ciśnienie w systemie, tym szybciej ta linia się podnosi.
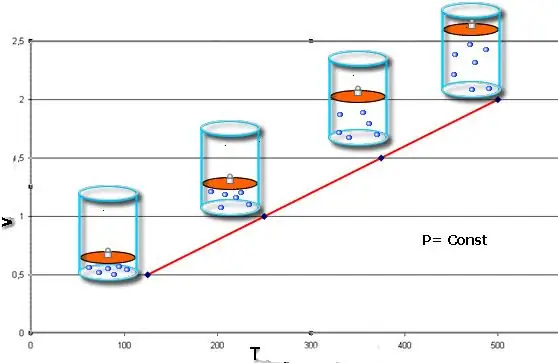
Proces izobaryczny jest łatwy do wdrożenia, jeśli gaz jest podgrzewany pod tłokiem. Cząsteczki tych ostatnich zwiększają swoją prędkość (energię kinetyczną), wytwarzają wyższe ciśnienie na tłoku, co prowadzi do rozprężania się gazu i utrzymania stałej wartości P.
Wreszcie trzeci izoproces jest izochoryczny. Działa ze stałą objętością. Z równania stanu otrzymujemy odpowiednią równość:
P/T=const.
Znane jest wśród fizyków jako prawo Gay-Lussaca. Bezpośrednia proporcjonalność między ciśnieniem a temperaturą bezwzględną wskazuje, że wykres procesu izochorycznego, podobnie jak wykres izobaryki, jest linią prostą o dodatnim nachyleniu.
Ważne jest, aby zrozumieć, że wszystkie izoprocesy występują w systemach zamkniętych, to znaczy, że wartość n jest zachowywana podczas ich przebiegu.
Proces adiabatyczny
Ten proces nie należy do kategorii „izo”, ponieważ wszystkie trzy parametry termodynamiczne zmieniają się podczas jego przejścia. adiabatycznynazywamy przejściem pomiędzy dwoma stanami układu, w którym nie wymienia ciepła z otoczeniem. W ten sposób rozbudowa systemu odbywa się dzięki jego wewnętrznym zapasom energii, co prowadzi do znacznego spadku ciśnienia i temperatury bezwzględnej w nim.
Proces adiabatyczny dla gazu doskonałego jest opisany równaniami Poissona. Jeden z nich pokazano poniżej:
PVγ=const,
gdzie γ jest stosunkiem pojemności cieplnej przy stałym ciśnieniu i przy stałej objętości.
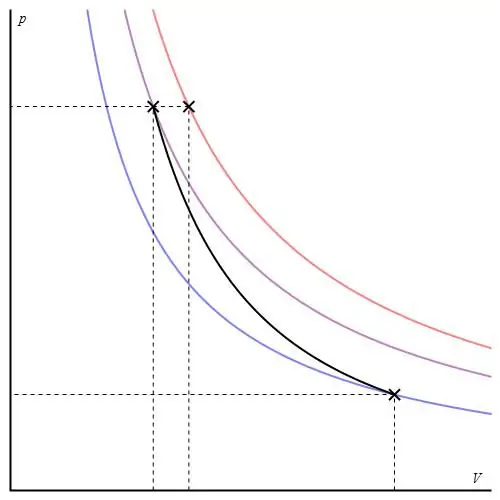
Wykres adiabatyczny różni się od izochorycznego wykresu procesu i od izobarycznego wykresu, ale jest podobny do hiperboli (izotermy). Adiabat w osiach P-V zachowuje się ostrzej niż izoterma.






