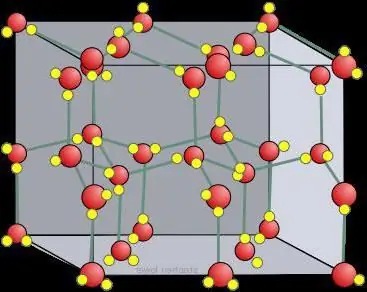
Trójwymiarowy stan ciekłej wody jest trudny do zbadania, ale wiele się nauczyliśmy analizując strukturę kryształków lodu. Cztery sąsiednie atomy tlenu oddziałujące z wodorem zajmują wierzchołki czworościanu (tetra=cztery, hedron=płaszczyzna). Średnia energia wymagana do zerwania takiego wiązania w lodzie szacowana jest na 23 kJ/mol-1.

Zdolność cząsteczek wody do tworzenia określonej liczby łańcuchów wodorowych, a także określonej siły, powoduje niezwykle wysoką temperaturę topnienia. Kiedy się topi, jest utrzymywany przez płynną wodę, której struktura jest nieregularna. Większość wiązań wodorowych jest zniekształcona. Rozbicie sieci krystalicznej lodu związanego wiązaniami wodorowymi wymaga dużej ilości energii w postaci ciepła.
Cechy wyglądu lodu (Ih)
Wielu mieszkańców zastanawia się, jaki rodzaj lodu ma sieć krystaliczna. NiezbędnyNależy zauważyć, że gęstość większości substancji wzrasta podczas zamrażania, gdy ruchy molekularne spowalniają i tworzą się gęsto upakowane kryształy. Gęstość wody również wzrasta, gdy ochładza się ona do maksimum przy 4°C (277K). Następnie, gdy temperatura spadnie poniżej tej wartości, rozszerza się.
Ten wzrost jest spowodowany tworzeniem się otwartego kryształu lodu związanego wiązaniami wodorowymi z jego siecią i mniejszą gęstością, w którym każda cząsteczka wody jest sztywno związana przez powyższy pierwiastek i cztery inne wartości, poruszając się wystarczająco szybko, aby mieć większą masę. Ponieważ to działanie ma miejsce, ciecz zamarza od góry do dołu. Ma to ważne skutki biologiczne, w wyniku których warstwa lodu na stawie izoluje żywe istoty od ekstremalnego zimna. Ponadto dwie dodatkowe właściwości wody są związane z jej właściwościami wodorowymi: ciepło właściwe i parowanie.
Szczegółowy opis struktur
Pierwszym kryterium jest ilość potrzebna do podniesienia temperatury 1 grama substancji o 1°C. Podnoszenie stopni wody wymaga stosunkowo dużej ilości ciepła, ponieważ każda cząsteczka jest zaangażowana w liczne wiązania wodorowe, które muszą zostać zerwane, aby energia kinetyczna wzrosła. Nawiasem mówiąc, obfitość H2O w komórkach i tkankach wszystkich dużych organizmów wielokomórkowych oznacza, że wahania temperatury wewnątrz komórek są zminimalizowane. Ta cecha jest kluczowa, ponieważ szybkość większości reakcji biochemicznychwrażliwe.
Ciepło parowania wody jest również znacznie wyższe niż w przypadku wielu innych cieczy. Do przekształcenia tego ciała w gaz potrzebna jest duża ilość ciepła, ponieważ wiązania wodorowe muszą zostać zerwane, aby cząsteczki wody oddaliły się od siebie i weszły we wspomnianą fazę. Ciała zmienne są trwałymi dipolami i mogą wchodzić w interakcje z innymi podobnymi związkami oraz tymi, które jonizują i rozpuszczają się.
Inne substancje wymienione powyżej mogą wejść w kontakt tylko wtedy, gdy występuje polaryzacja. To właśnie ten związek bierze udział w budowie tych pierwiastków. Ponadto może ustawiać się wokół tych cząstek utworzonych z elektrolitów, dzięki czemu ujemne atomy tlenu cząsteczek wody są zorientowane na kationy, a jony dodatnie i atomy wodoru są zorientowane na aniony.
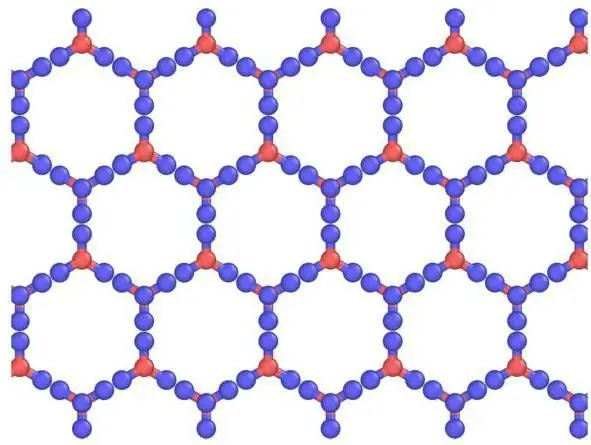
W ciałach stałych z reguły powstają molekularne sieci krystaliczne i sieci atomowe. To znaczy, jeśli jod jest zbudowany w taki sposób, że zawiera I2, , to w stałym dwutlenku węgla, czyli w suchym lodzie, cząsteczki CO2 są zlokalizowane w węzłach sieci krystalicznej . Podczas interakcji z podobnymi substancjami lód ma jonową sieć krystaliczną. Na przykład grafit, który ma strukturę atomową opartą na węglu, nie jest w stanie tego zmienić, podobnie jak diament.
Co się dzieje, gdy kryształ soli kuchennej rozpuszcza się w wodzie: cząsteczki polarne są przyciągane do naładowanych pierwiastków w krysztale, co prowadzi do powstawania na jego powierzchni podobnych cząsteczek sodu i chloru, co powoduje powstanie tych ciałsą od siebie oddzielone i zaczyna się rozpuszczać. Stąd można zaobserwować, że lód ma sieć krystaliczną z wiązaniami jonowymi. Każdy rozpuszczony Na+ przyciąga ujemne końce kilku cząsteczek wody, a każdy rozpuszczony Cl - przyciąga dodatnie końce. Powłoka otaczająca każdy jon nazywana jest sferą ucieczki i zwykle zawiera kilka warstw cząsteczek rozpuszczalnika.
Kratka kryształków suchego lodu
Zmienne lub jon otoczony pierwiastkami są uważane za siarczanowane. Gdy rozpuszczalnikiem jest woda, takie cząstki ulegają uwodnieniu. Tak więc każda cząsteczka polarna ma tendencję do solwatowania przez elementy ciała ciekłego. W suchym lodzie rodzaj sieci krystalicznej tworzy wiązania atomowe w stanie agregacji, które pozostają niezmienione. Kolejną rzeczą jest krystaliczny lód (zamrożona woda). Jonowe związki organiczne, takie jak karboksylaza i protonowane aminy, muszą być rozpuszczalne w grupach hydroksylowych i karbonylowych. Cząstki zawarte w takich strukturach poruszają się między cząsteczkami, a ich układy polarne tworzą z tym ciałem wiązania wodorowe.
Oczywiście liczba ostatnich wskazanych grup w cząsteczce wpływa na jej rozpuszczalność, która również zależy od reakcji różnych struktur w elemencie: na przykład mieszają się alkohole jedno-, dwu- i trzywęglowe z wodą, ale większe węglowodory z pojedynczymi związkami hydroksylowymi są znacznie mniej rozcieńczone w cieczach.
Heksagonalny Ih ma kształt podobny doatomowa sieć krystaliczna. W przypadku lodu i całego naturalnego śniegu na Ziemi wygląda to dokładnie tak. Świadczy o tym symetria sieci krystalicznej lodu, wyhodowanego z pary wodnej (czyli płatków śniegu). Znajduje się w grupie kosmicznej P 63/mm od 194; D 6h, klasa Laue 6/mm; podobny do β-, który ma wielokrotność 6 osi śrubowej (obrót wokół oraz przesunięcie wzdłuż niej). Ma dość otwartą strukturę o niskiej gęstości, w której wydajność jest niska (~1/3) w porównaniu z prostymi sześciennymi (~1/2) lub sześciennymi strukturami wyśrodkowanymi na powierzchni (~3/4).
W porównaniu ze zwykłym lodem, sieć krystaliczna suchego lodu, związana cząsteczkami CO2, jest statyczna i zmienia się tylko w przypadku rozpadu atomów.
Opis krat i ich elementów
Kryształy można oglądać jako modele krystaliczne, składające się z arkuszy umieszczonych jeden nad drugim. Wiązanie wodorowe jest uporządkowane, podczas gdy w rzeczywistości jest przypadkowe, ponieważ protony mogą poruszać się między cząsteczkami wody (lodu) w temperaturach powyżej około 5 K. Rzeczywiście, jest prawdopodobne, że protony zachowują się jak płyn kwantowy w stałym przepływie tunelowym. Jest to wzmocnione przez rozpraszanie neutronów, pokazujące ich gęstość rozpraszania w połowie odległości między atomami tlenu, co wskazuje na lokalizację i skoordynowany ruch. Tutaj jest podobieństwo lodu do atomowej, molekularnej sieci krystalicznej.
Cząsteczki mają naprzemienny układ łańcucha wodorowegow stosunku do trzech sąsiadów w samolocie. Czwarty pierwiastek ma zaćmiony układ wiązań wodorowych. Istnieje niewielkie odchylenie od idealnej symetrii heksagonalnej, ponieważ komórka elementarna jest o 0,3% krótsza w kierunku tego łańcucha. Wszystkie cząsteczki doświadczają tych samych środowisk molekularnych. Wewnątrz każdego „pudełka” jest wystarczająco dużo miejsca, aby pomieścić cząsteczki wody śródmiąższowej. Chociaż nie są powszechnie brane pod uwagę, zostały ostatnio skutecznie wykryte za pomocą dyfrakcji neutronowej proszkowej sieci krystalicznej lodu.
Zmiana substancji
Sześciokątny korpus ma potrójne punkty z wodą ciekłą i gazową 0,01°C, 612 Pa, elementy stałe - trzy -21,985 °C, 209,9 MPa, jedenaście i dwa -199,8 °C, 70 MPa, a także - 34,7°C, 212,9 MPa. Stała dielektryczna heksagonalnego lodu wynosi 97,5.
Krzywa topnienia tego pierwiastka jest podana przez MPa. Dostępne są równania stanu, oprócz nich kilka prostych nierówności związanych ze zmianą właściwości fizycznych od temperatury lodu heksagonalnego i jego wodnych zawiesin. Twardość zmienia się ze stopniami rosnącymi od lub poniżej gipsu (≦2) w 0°C do skalenia (6 Mohs) w -80°C, nienormalnie duża zmiana twardości bezwzględnej (> 24 razy).
Heksagonalna sieć krystaliczna lodu tworzy heksagonalne płyty i kolumny, w których górna i dolna powierzchnia są płaszczyznami podstawowymi {0 0 0 1} o entalpii 5,57 μJ cm -2, a inne równoważne części boczne nazywane są częściami pryzmatu {1 0 -1 0} z 5, 94µJ cm -2. Powierzchnie drugorzędne {1 1 -2 0} o 6,90 ΜJ ˣ cm -2 mogą być tworzone wzdłuż płaszczyzn utworzonych przez boki konstrukcji.
Taka struktura wykazuje anomalny spadek przewodności cieplnej wraz ze wzrostem ciśnienia (a także kubiczny i amorficzny lód o niskiej gęstości), ale różni się od większości kryształów. Wynika to ze zmiany wiązania wodorowego, które zmniejsza poprzeczną prędkość dźwięku w sieci krystalicznej lodu i wody.
Istnieją metody opisujące sposób przygotowania dużych próbek kryształów i dowolnej pożądanej powierzchni lodu. Zakłada się, że wiązanie wodorowe na powierzchni badanej bryły heksagonalnej będzie bardziej uporządkowane niż wewnątrz układu masowego. Spektroskopia wariacyjna z generowaniem częstotliwości fazowo-sieciowej wykazała, że istnieje strukturalna asymetria między dwiema górnymi warstwami (L1 i L2) w podpowierzchniowym łańcuchu HO powierzchni podstawowej lodu heksagonalnego. Przyjęte wiązania wodorowe w górnych warstwach heksagonów (L1 O ··· HO L2) są silniejsze niż te przyjęte w warstwie drugiej do akumulacji górnej (L1 OH ··· O L2). Dostępne interaktywne sześciokątne struktury lodowe.
Funkcje programistyczne
Minimalna liczba cząsteczek wody potrzebnych do wytworzenia lodu wynosi około 275 ± 25, tak jak w przypadku kompletnego klastra dwudziestościennego liczącego 280. Formowanie następuje w tempie 10 10 na granicy faz powietrze-woda, a nie w wodzie luzem. Wzrost kryształków lodu zależy od różnych szybkości wzrostu różnychenergie. Woda musi być chroniona przed zamarzaniem podczas kriokonserwacji próbek biologicznych, żywności i narządów.
Zwykle osiąga się to dzięki dużej szybkości chłodzenia, użyciu małych próbek i kriokonserwatora oraz zwiększeniu ciśnienia w celu zarodkowania lodu i zapobiegania uszkodzeniom komórek. Energia swobodna lodu/cieczy wzrasta z ~30 mJ/m2 przy ciśnieniu atmosferycznym do 40 mJ/m-2 przy 200 MPa, co wskazuje powód, dla którego występuje ten efekt.
Jaki rodzaj sieci krystalicznej jest charakterystyczny dla lodu
Alternatywnie mogą rosnąć szybciej z powierzchni pryzmatycznych (S2), na przypadkowo zaburzonej powierzchni szybko zamarzniętych lub wzburzonych jezior. Wzrost ze ścian {1 1 -20} jest co najmniej taki sam, ale zamienia je w podstawy pryzmatu. Dane dotyczące rozwoju kryształu lodu zostały w pełni zbadane. Względne tempo wzrostu elementów o różnych powierzchniach zależy od zdolności do wytworzenia dużego stopnia uwodnienia stawu. Temperatura (niska) otaczającej wody określa stopień rozgałęzienia kryształu lodu. Wzrost cząstek jest ograniczony szybkością dyfuzji przy niskim stopniu przechłodzenia, tj. <2 ° C, co skutkuje ich większą liczbą.

Ale ograniczone przez kinetykę rozwoju przy wyższych poziomach depresji >4°C, co powoduje wzrost igieł. Kształt ten jest zbliżony do budowy suchego lodu (ma sieć krystaliczną o strukturze heksagonalnej), różnecharakterystyka zagospodarowania powierzchni oraz temperatura otaczającej (przechłodzonej) wody, która kryje się za płaskimi kształtami płatków śniegu.
Tworzenie się lodu w atmosferze ma ogromny wpływ na powstawanie i właściwości chmur. Skaleń, znaleziony w pustynnym pyle, który dostaje się do atmosfery w milionach ton rocznie, są ważnymi prekursorami. Symulacje komputerowe wykazały, że jest to spowodowane zarodkowaniem pryzmatycznych płaszczyzn kryształów lodu na wysokoenergetycznych płaszczyznach powierzchni.
Niektóre inne elementy i kraty
Substancje rozpuszczone (z wyjątkiem bardzo małych helu i wodoru, które mogą wnikać w szczeliny) nie mogą być zawarte w strukturze Ih pod ciśnieniem atmosferycznym, ale są wypychane na powierzchnię lub warstwę amorficzną pomiędzy cząsteczkami ciało mikrokrystaliczne. Istnieje kilka innych pierwiastków w sieciach suchego lodu: jony chaotropowe, takie jak NH4 + i Cl - które są zawarte w lżejszym zamrażaniu cieczy niż inne kosmotropowe, takie jak Na + i SO42-, więc ich usunięcie nie jest możliwe, ponieważ tworzą cienką warstwę pozostałej cieczy między kryształami. Może to prowadzić do elektrycznego naładowania powierzchni w wyniku dysocjacji wody powierzchniowej równoważącej pozostałe ładunki (co może również prowadzić do promieniowania magnetycznego) oraz zmiany pH pozostałości cieczy, np. NH 42SO4 staje się bardziej kwaśny, a NaCl staje się bardziej zasadowy.
Są prostopadłe do twarzysieć krystaliczna lodu ukazująca przyłączoną następną warstwę (z atomami O w kolorze czarnym). Charakteryzują się wolno rosnącą powierzchnią podstawową {0 0 0 1}, do której przyłączone są tylko izolowane cząsteczki wody. Szybko rosnąca {10 -10} powierzchnia pryzmatu, na której pary nowo przyłączonych cząstek mogą wiązać się ze sobą wodorem (jedno wiązanie wodorowe/dwie cząsteczki pierwiastka). Najszybciej rosnąca ściana to {1 1 -2 0} (wtórny pryzmatyczny), gdzie łańcuchy nowo przyłączonych cząstek mogą oddziaływać ze sobą poprzez wiązania wodorowe. Jednym z jej łańcuchów/cząsteczek pierwiastków jest forma tworząca grzbiety, które dzielą i zachęcają do przekształcenia w dwie strony pryzmatu.
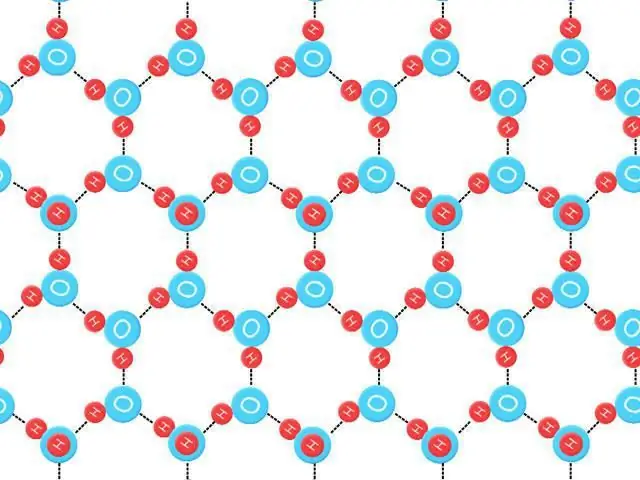
Entropia punktu zerowego
Może być zdefiniowany jako S 0=k B ˣ Ln (N E0), gdzie k B jest stałą Boltzmanna, NE jest liczbą konfiguracji przy energii E, a E0 jest najniższą energią. Ta wartość entropii heksagonalnego lodu przy zerze Kelvina nie narusza trzeciej zasady termodynamiki „Entropia idealnego kryształu przy zera absolutnym wynosi dokładnie zero”, ponieważ te pierwiastki i cząstki nie są idealne, mają nieuporządkowane wiązania wodorowe.
W tym ciele wiązanie wodorowe jest przypadkowe i szybko się zmienia. Struktury te nie są dokładnie równe pod względem energii, ale rozciągają się na bardzo dużą liczbę stanów bliskich energetycznie, przestrzegają „zasad lodu”. Entropia punktu zerowego to zaburzenie, które pozostałoby, nawet gdyby materiał można było schłodzić do wartości absolutnejzero (0 K=-273, 15 ° C). Generuje eksperymentalne zamieszanie dla sześciokątnego lodu 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretycznie możliwe byłoby obliczenie zerowej entropii znanych kryształów lodu ze znacznie większą dokładnością (pomijając defekty i rozrzut poziomów energii) niż wyznaczenie jej eksperymentalnie.
Naukowcy i ich praca w tej dziedzinie
Może być zdefiniowany jako S 0=k B ˣ Ln (N E0), gdzie k B jest stałą Boltzmanna, NE jest liczbą konfiguracji przy energii E, a E0 jest najniższą energią. Ta wartość entropii heksagonalnego lodu przy zerze Kelvina nie narusza trzeciej zasady termodynamiki „Entropia idealnego kryształu przy zera absolutnym wynosi dokładnie zero”, ponieważ te pierwiastki i cząstki nie są idealne, mają nieuporządkowane wiązania wodorowe.
W tym ciele wiązanie wodorowe jest przypadkowe i szybko się zmienia. Struktury te nie są dokładnie równe pod względem energii, ale rozciągają się na bardzo dużą liczbę stanów bliskich energetycznie, przestrzegają „zasad lodu”. Entropia punktu zerowego to zaburzenie, które pozostałoby, nawet gdyby materiał można było schłodzić do zera absolutnego (0 K=-273,15°C). Generuje eksperymentalne zamieszanie dla sześciokątnego lodu 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretycznie możliwe byłoby obliczenie zerowej entropii znanych kryształów lodu ze znacznie większą dokładnością (pomijając defekty i rozrzut poziomów energii) niż wyznaczenie jej eksperymentalnie.

Chociaż kolejność protonów w masie lodu nie jest uporządkowana, powierzchnia prawdopodobnie preferuje kolejność tych cząstek w postaci pasm wiszących atomów H i par O-singli (zero entropii z uporządkowanymi wiązaniami wodorowymi). Znaleziono zaburzenie punktu zerowego ZPE, J ˣ mol -1 ˣ K -1 i inne. Z powyższego wynika jasno i zrozumiałe, jakie rodzaje sieci krystalicznych są charakterystyczne dla lodu.






