Pojemność cieplna gazu to ilość energii, którą ciało pochłania po podgrzaniu o jeden stopień. Przeanalizujmy główne cechy tej wielkości fizycznej.

Definicje
Ciepło właściwe gazu to jednostka masy określonej substancji. Jego jednostkami miary są J/(kg·K). Ilość ciepła, którą organizm pochłonie w procesie zmiany swojego stanu skupienia, związana jest nie tylko ze stanem początkowym i końcowym, ale także ze sposobem przejścia.

Dział
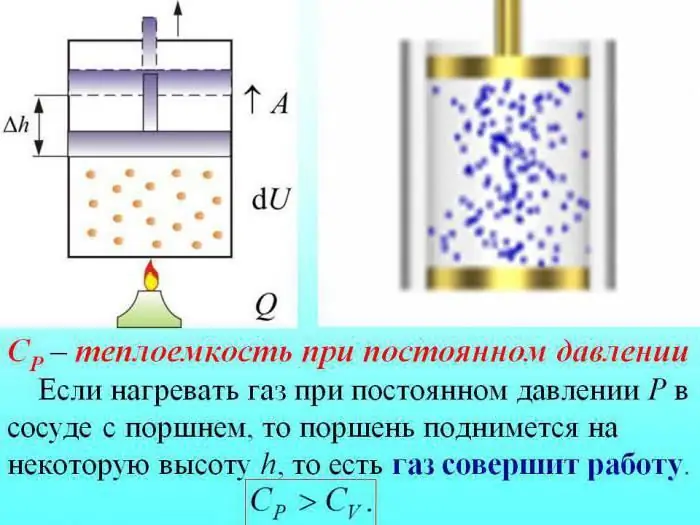
Pojemność cieplna gazów jest dzielona przez wartość określoną przy stałej objętości (Cv), stałym ciśnieniu (Cр).
W przypadku ogrzewania bez zmiany ciśnienia, część ciepła jest zużywana na wytworzenie pracy polegającej na rozprężaniu gazu, a część energii jest zużywana na zwiększenie energii wewnętrznej.
Pojemność cieplna gazów przy stałym ciśnieniu jest określona przez ilość ciepła zużywanego na zwiększenie energii wewnętrznej.
Stan gazu: cechy, opis
Pojemność cieplna gazu doskonałego jest określana z uwzględnieniem faktu, że Сp-Сv=R. Ta ostatnia wielkość nazywana jest uniwersalną stałą gazową. Jego wartość odpowiada 8,314 J/(mol K).
Podczas wykonywania teoretycznych obliczeń pojemności cieplnej, na przykład opisujących związek z temperaturą, nie wystarczy posługiwać się wyłącznie metodami termodynamicznymi, ważne jest uzbroić się w elementy fizyki statycznej.
Pojemność cieplna gazów obejmuje obliczenie średniej wartości energii ruchu postępowego niektórych cząsteczek. Ruch taki sumuje się z ruchu obrotowego i translacyjnego cząsteczki, a także z wewnętrznych drgań atomów.
W fizyce statycznej istnieje informacja, że dla każdego stopnia swobody ruchu obrotowego i translacyjnego istnieje ilość gazu równa połowie uniwersalnej stałej gazowej.

Ciekawe fakty
Zakłada się, że cząsteczka gazu jednoatomowego ma trzy translacyjne stopnie swobody, więc ciepło właściwe gazu ma trzy translacyjne, dwa rotacyjne i jeden wibracyjny stopnie swobody. Prawo ich równomiernego rozkładu prowadzi do zrównania ciepła właściwego przy stałej objętości z R.
Podczas eksperymentów ustalono, że pojemność cieplna gazu dwuatomowego odpowiada wartości R. Taką rozbieżność między teorią a praktyką tłumaczy się tym, że pojemność cieplna gazu doskonałego jest powiązana z kwantową efekty, dlatego przy dokonywaniu obliczeń ważne jest, aby korzystać ze statystyk opartych na kwantachmechanika.
W oparciu o podstawy mechaniki kwantowej, każdy system cząstek, które oscylują lub obracają się, w tym cząsteczki gazu, ma tylko pewne dyskretne wartości energii.
Jeżeli energia ruchu termicznego w systemie nie jest wystarczająca do wzbudzenia oscylacji o określonej częstotliwości, takie ruchy nie mają wpływu na całkowitą pojemność cieplną systemu.
W rezultacie określony stopień swobody zostaje „zamrożony”, niemożliwe jest zastosowanie do niego prawa ekwipartycji.
Pojemność cieplna gazów jest ważną cechą stanu, od którego zależy funkcjonowanie całego układu termodynamicznego.
Temperatura, w której prawo ekwipartycji może być zastosowane do wibracyjnego lub obrotowego stopnia swobody, jest scharakteryzowana przez teorię kwantową, łączy stałą Plancka ze stałą Boltzmanna.

Gazy dwuatomowe
Odstępy między poziomami energii rotacyjnej takich gazów wynoszą niewielką liczbę stopni. Wyjątkiem jest wodór, w którym wartość temperatury określana jest przez setki stopni.
Dlatego pojemność cieplna gazu przy stałym ciśnieniu jest trudna do opisania prawem równomiernego rozkładu. W statystyce kwantowej przy wyznaczaniu pojemności cieplnej bierze się pod uwagę, że jej część wibracyjna w przypadku spadku temperatury szybko spada i osiąga zero.
Zjawisko to wyjaśnia fakt, że w temperaturze pokojowej praktycznie nie występuje wibracyjna część pojemności cieplnej, ponieważgaz dwuatomowy, odpowiada stałej R.
Pojemność cieplna gazu o stałej objętości w przypadku wskaźników niskotemperaturowych jest określana za pomocą statystyki kwantowej. Istnieje zasada Nernsta, zwana trzecią zasadą termodynamiki. Na podstawie jego formuły molowa pojemność cieplna gazu będzie się zmniejszać wraz ze spadkiem temperatury, dążąc do zera.

Cechy brył
Jeżeli pojemność cieplną mieszaniny gazów można wyjaśnić za pomocą statystyki kwantowej, to dla stanu skupienia ciała stałego ruch termiczny charakteryzuje się niewielkimi fluktuacjami cząstek w pobliżu położenia równowagi.
Każdy atom ma trzy stopnie swobody drgań, dlatego zgodnie z prawem ekwipartycji molowa pojemność cieplna ciała stałego może być obliczona jako 3nR, gdzie n jest liczbą atomów w cząsteczce.
W praktyce ta liczba jest granicą, do której zbliża się pojemność cieplna ciała stałego w wysokich temperaturach.
Maksimum można uzyskać w zwykłych temperaturach dla niektórych pierwiastków, w tym metali. Dla n=1 spełnione jest prawo Dulonga i Petita, ale dla substancji złożonych raczej trudno jest osiągnąć taki limit. Ponieważ w rzeczywistości nie można uzyskać granicy, następuje rozkład lub topnienie ciała stałego.
Historia teorii kwantowej
Założycielami teorii kwantowej byli Einstein i Debye na początku XX wieku. Polega na kwantyzacji ruchów oscylacyjnych atomów w pewnymkryształ. W przypadku wskaźników niskiej temperatury pojemność cieplna ciała stałego okazuje się wprost proporcjonalna do wartości bezwzględnej pobranej w sześcianie. Ten związek został nazwany prawem Debye'a. Jako kryterium pozwalające na rozróżnienie wskaźników niskiej i wysokiej temperatury przyjmuje się ich porównanie z temperaturą Debye'a.
Ta wartość jest określona przez widmo drgań atomu w ciele, dlatego w dużej mierze zależy od cech jego struktury krystalicznej.
QD to wartość, która ma kilkaset K, ale na przykład jest znacznie wyższa w przypadku diamentu.
Elektrony przewodzące mają znaczący wpływ na pojemność cieplną metali. Do jej obliczenia wykorzystywane są statystyki kwantowe Fermiego. Przewodność elektronowa atomów metali jest wprost proporcjonalna do temperatury bezwzględnej. Ponieważ jest to wartość nieistotna, bierze się ją pod uwagę tylko w temperaturach zmierzających do zera bezwzględnego.
Metody określania pojemności cieplnej
Główną metodą eksperymentalną jest kalorymetria. Do przeprowadzenia teoretycznych obliczeń pojemności cieplnej wykorzystuje się termodynamikę statystyczną. Dotyczy to zarówno gazu doskonałego, jak i ciał krystalicznych, jest przeprowadzane na podstawie danych eksperymentalnych dotyczących struktury materii.
Empiryczne metody obliczania pojemności cieplnej gazu doskonałego opierają się na idei budowy chemicznej, udziale poszczególnych grup atomów w Ср.
W przypadku cieczy stosowane są również metody oparte na wykorzystaniu termodynamikicykle umożliwiające przejście od pojemności cieplnej gazu doskonałego do cieczy przez pochodną temperatury entalpii procesu parowania.
W przypadku rozwiązania, obliczanie pojemności cieplnej jako funkcji addytywnej jest niedozwolone, ponieważ nadwyżka wartości pojemności cieplnej roztworu jest zasadniczo znacząca.
Aby to ocenić, potrzebujemy molekularno-statystycznej teorii rozwiązań. Najtrudniejsza jest identyfikacja pojemności cieplnej układów heterogenicznych w analizie termodynamicznej.

Wniosek
Badanie pojemności cieplnej pozwala obliczyć bilans energetyczny procesów zachodzących w reaktorach chemicznych, a także w innych chemicznych aparatach produkcyjnych. Dodatkowo ta wartość jest niezbędna do doboru optymalnych rodzajów chłodziw.
Obecnie eksperymentalne wyznaczanie pojemności cieplnej substancji dla różnych przedziałów temperaturowych - od wartości niskich do wartości wysokich - jest główną opcją wyznaczania charakterystyk termodynamicznych substancji. Przy obliczaniu entropii i entalpii substancji wykorzystuje się całki pojemności cieplnej. Informacja o pojemności cieplnej odczynników chemicznych w określonym zakresie temperatur pozwala obliczyć efekt cieplny procesu. Informacja o pojemności cieplnej roztworów umożliwia obliczenie ich parametrów termodynamicznych przy dowolnych wartościach temperatury w analizowanym przedziale.
Na przykład ciecz charakteryzuje się wydatkowaniem części ciepła na zmianę wartości energii potencjalnejreagujące cząsteczki. Wartość ta nazywana jest pojemnością cieplną „konfiguracji”, używaną do opisu rozwiązań.
Trudno przeprowadzić pełne obliczenia matematyczne bez uwzględnienia termodynamicznych właściwości substancji, jej stanu skupienia. Dlatego dla cieczy, gazów, ciał stałych stosuje się taką charakterystykę jak ciepło właściwe, co umożliwia scharakteryzowanie parametrów energetycznych substancji.






