Świat, w którym żyjemy, jest niewyobrażalnie piękny i pełen wielu różnych procesów, które wyznaczają kierunek życia. Wszystkie te procesy bada znana nauka - fizyka. Daje możliwość uzyskania przynajmniej pewnego wyobrażenia o pochodzeniu wszechświata. W tym artykule rozważymy takie pojęcie jak teoria kinetyki molekularnej, jej równania, typy i formuły. Jednak zanim przejdziesz do głębszego badania tych zagadnień, musisz wyjaśnić samemu znaczenie fizyki i dziedzin, które bada.
Co to jest fizyka?

W rzeczywistości jest to bardzo obszerna nauka i być może jedna z najbardziej fundamentalnych w historii ludzkości. Na przykład, jeśli ta sama informatyka jest związana z prawie każdym obszarem ludzkiej działalności, czy to projektowaniem obliczeniowym, czy tworzeniem kreskówek, to fizyka jest samym życiem, opisem jego złożonych procesów i przepływów. Spróbujmy zrozumieć jego znaczenie, maksymalnie upraszczając zrozumienie.
TakFizyka jest więc nauką zajmującą się badaniem energii i materii, powiązań między nimi, wyjaśnieniem wielu procesów zachodzących w naszym rozległym wszechświecie. Teoria molekularno-kinetyczna budowy materii to tylko mała kropla w morzu teorii i gałęzi fizyki.
Energia, którą ta nauka szczegółowo bada, może być reprezentowana w różnych formach. Na przykład w postaci światła, ruchu, grawitacji, promieniowania, elektryczności i wielu innych form. W tym artykule dotkniemy molekularnej teorii kinetycznej struktury tych form.
Badanie materii daje nam wyobrażenie o atomowej strukturze materii. Nawiasem mówiąc, wynika to z teorii kinetyki molekularnej. Nauka o budowie materii pozwala nam zrozumieć i znaleźć sens naszego istnienia, przyczyny powstania życia i samego Wszechświata. Spróbujmy nadal badać molekularną teorię kinetyczną materii.
Po pierwsze, potrzebne jest wprowadzenie, aby w pełni zrozumieć terminologię i wszelkie wnioski.
Tematy fizyki
Odpowiadając na pytanie, czym jest teoria kinetyki molekularnej, nie można nie mówić o sekcjach fizyki. Każda z nich dotyczy szczegółowego badania i wyjaśniania konkretnego obszaru życia człowieka. Są one klasyfikowane w następujący sposób:
- Mechanika, która jest podzielona na jeszcze dwie sekcje: kinematykę i dynamikę.
- Statyczny.
- Termodynamika.
- Sekcja molekularna.
- Elektrodynamika.
- Optyka.
- Fizyka kwantów i jądra atomowego.
Porozmawiajmy konkretnie o cząsteczcefizyki, ponieważ opiera się na teorii kinetyki molekularnej.
Co to jest termodynamika?
Ogólnie rzecz biorąc, część molekularna i termodynamika są ściśle powiązanymi gałęziami fizyki, które badają wyłącznie makroskopowy składnik całkowitej liczby układów fizycznych. Warto pamiętać, że nauki te precyzyjnie opisują stan wewnętrzny ciał i substancji. Na przykład ich stan podczas ogrzewania, krystalizacji, parowania i kondensacji na poziomie atomowym. Innymi słowy, fizyka molekularna to nauka o układach składających się z ogromnej liczby cząstek: atomów i cząsteczek.
To właśnie te nauki badały główne założenia molekularnej teorii kinetycznej.
Nawet w siódmej klasie poznaliśmy pojęcia mikro- i makro-światów, systemów. Odświeżenie tych terminów w pamięci nie będzie zbyteczne.
Mikroświat, jak widać już po jego nazwie, składa się z cząstek elementarnych. Innymi słowy, jest to świat małych cząstek. Ich rozmiary są mierzone w zakresie od 10-18 m do 10-4 m, a czas ich faktycznego stanu może sięgać zarówno nieskończoności, jak i nieproporcjonalnie małe interwały, na przykład 10-20 s.
Macroworld rozważa ciała i układy o stabilnych formach, składające się z wielu cząstek elementarnych. Takie systemy są współmierne do rozmiarów naszego człowieka.
Ponadto istnieje coś takiego jak megaświat. Składa się z ogromnych planet, kosmicznych galaktyk i kompleksów.
Podstawyteoria
Teraz, gdy trochę podsumowaliśmy i przypomnieliśmy sobie podstawowe pojęcia fizyki, możemy przejść bezpośrednio do głównego tematu tego artykułu.
Teoria molekularno-kinetyczna pojawiła się i została sformułowana po raz pierwszy w XIX wieku. Jej istota polega na tym, że szczegółowo opisuje budowę dowolnej substancji (częściej strukturę gazów niż ciał stałych i ciekłych), w oparciu o trzy podstawowe przepisy, które zostały zebrane z założeń tak wybitnych naukowców jak Robert Hooke, Izaak. Newton, Daniel Bernoulli, Michaił Łomonosow i wielu innych.
Główne postanowienia teorii kinetyki molekularnej brzmią tak:
- Absolutnie wszystkie substancje (niezależnie od tego, czy są płynne, stałe czy gazowe) mają złożoną strukturę, składającą się z mniejszych cząstek: cząsteczek i atomów. Atomy są czasami nazywane „cząsteczkami elementarnymi”.
- Wszystkie te cząstki elementarne są zawsze w stanie ciągłego i chaotycznego ruchu. Każdy z nas natknął się na bezpośredni dowód tej propozycji, ale najprawdopodobniej nie przywiązywał do tego większej wagi. Na przykład wszyscy widzieliśmy na tle promieni słonecznych, że cząsteczki kurzu nieustannie poruszają się w chaotycznym kierunku. Wynika to z faktu, że atomy wytwarzają ze sobą wzajemne popchnięcia, stale przekazując sobie nawzajem energię kinetyczną. Zjawisko to zostało po raz pierwszy zbadane w 1827 roku i zostało nazwane na cześć odkrywcy - "Ruch Browna".
- Wszystkie cząstki elementarne są w ciągłym oddziaływaniu ze sobą zpewne siły, które mają elektryczny kamień.
Warto zauważyć, że kolejnym przykładem opisującym pozycję numer dwa, który może również odnosić się np. do molekularnej teorii kinetycznej gazów, jest dyfuzja. Spotykamy się z nim w codziennym życiu, w wielu testach i kontrolach, dlatego ważne jest, aby mieć o tym pojęcie.
Najpierw rozważ następujące przykłady:
Lekarz przypadkowo wylał alkohol z butelki na stole. A może upuściłeś butelkę perfum i rozlała się po całej podłodze.
Dlaczego w tych dwóch przypadkach zarówno zapach alkoholu, jak i zapach perfum wypełnią po pewnym czasie całe pomieszczenie, a nie tylko obszar, w którym rozlała się zawartość tych substancji?
Odpowiedź jest prosta: dyfuzja.
Dyfuzja - co to jest? Jak to płynie?

Jest to proces, w którym cząsteczki tworzące jedną konkretną substancję (zwykle gaz) wnikają w międzycząsteczkowe puste przestrzenie innej. W naszych powyższych przykładach wydarzyło się co następuje: z powodu ruchu termicznego, czyli ciągłego i zdysocjowanego ruchu, cząsteczki alkoholu i / lub perfum wpadły w szczeliny między cząsteczkami powietrza. Stopniowo pod wpływem zderzenia z atomami i cząsteczkami powietrza rozprzestrzeniają się po pomieszczeniu. Nawiasem mówiąc, intensywność dyfuzji, czyli prędkość jej przepływu, zależy od gęstości substancji biorących udział w dyfuzji, a także od energii ruchu ich atomów i cząsteczek, zwanej kinetyczną. Im większa energia kinetyczna, tym większa odpowiednio prędkość tych cząsteczek i intensywność.
Najszybszy proces dyfuzji można nazwać dyfuzją w gazach. Wynika to z faktu, że gaz nie jest jednorodny w swoim składzie, co oznacza, że luki międzycząsteczkowe w gazach zajmują odpowiednio znaczną ilość miejsca, a proces wnikania w nie atomów i cząsteczek obcej substancji przebiega łatwiej i szybciej.
Ten proces jest nieco wolniejszy w płynach. Rozpuszczenie kostek cukru w kubku herbaty to tylko przykład dyfuzji ciała stałego w cieczy.
Ale najdłużej trwa dyfuzja w ciałach o stałej strukturze krystalicznej. Dzieje się tak właśnie dlatego, że struktura ciał stałych jest jednorodna i posiada silną sieć krystaliczną, w której komórkach drgają atomy ciała stałego. Na przykład, jeśli powierzchnie dwóch metalowych prętów zostaną dobrze oczyszczone, a następnie zetkną się ze sobą, to po wystarczająco długim czasie będziemy w stanie wykryć kawałki jednego metalu w drugim i na odwrót.
Podobnie jak każda inna podstawowa sekcja, podstawowa teoria fizyki jest podzielona na oddzielne części: klasyfikacja, typy, wzory, równania i tak dalej. W ten sposób poznaliśmy podstawy teorii kinetyki molekularnej. Oznacza to, że możesz bezpiecznie przystąpić do rozpatrywania poszczególnych bloków teoretycznych.
Molekularno-kinetyczna teoria gazów
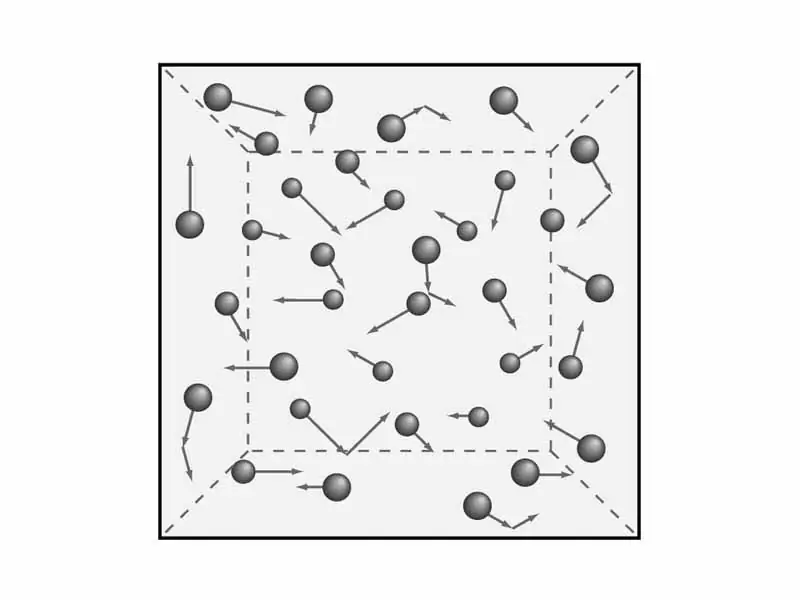
Istnieje potrzeba zrozumienia zapisów teorii gazu. Jak powiedzieliśmy wcześniej, rozważymy makroskopowe właściwości gazów, takie jak ciśnienie i temperatura. To jestbędą potrzebne później w celu wyprowadzenia równania molekularno-kinetycznej teorii gazów. Ale matematyka - później, a teraz zajmijmy się teorią i odpowiednio fizyką.
Naukowcy sformułowali pięć zapisów molekularnej teorii gazów, które służą do zrozumienia kinetycznego modelu gazów. Brzmią tak:
- Wszystkie gazy składają się z cząstek elementarnych, które nie mają określonego rozmiaru, ale mają określoną masę. Innymi słowy, objętość tych cząstek jest minimalna w porównaniu z długością między nimi.
- Atomy i cząsteczki gazów praktycznie nie mają odpowiednio energii potencjalnej, zgodnie z prawem cała energia jest równa energii kinetycznej.
- Z tą pozycją już zapoznaliśmy się wcześniej - ruchy Browna. Oznacza to, że cząsteczki gazu są zawsze w ciągłym i chaotycznym ruchu.
- Absolutnie wszystkie wzajemne zderzenia cząstek gazu, którym towarzyszy przesłanie prędkości i energii, są całkowicie elastyczne. Oznacza to, że podczas zderzenia nie dochodzi do utraty energii ani gwałtownych skoków ich energii kinetycznej.
- W normalnych warunkach i przy stałej temperaturze, średnia energia ruchu cząstek prawie wszystkich gazów jest taka sama.
Możemy przepisać piątą pozycję za pomocą tego typu równania molekularno-kinetycznej teorii gazów:
E=1/2mv^2=3/2kT, gdzie k jest stałą Boltzmanna; T - temperatura w kelwinach.
To równanie pozwala nam zrozumieć związek między prędkością elementarnych cząstek gazu a ich bezwzględną temperaturą. W związku z tym im wyższy ich absoluttemperatura, tym większa jest ich prędkość i energia kinetyczna.
Ciśnienie gazu
Takie makroskopowe składniki charakterystyki, takie jak ciśnienie gazów, można również wyjaśnić za pomocą teorii kinetycznej. Aby to zrobić, wyobraźmy sobie następujący przykład.
Załóżmy, że cząsteczka jakiegoś gazu znajduje się w pudełku o długości L. Skorzystajmy z zapisów teorii gazu opisanej powyżej i weźmy pod uwagę fakt, że kula molekularna porusza się tylko wzdłuż osi x -oś. W ten sposób będziemy mogli zaobserwować proces zderzenia sprężystego z jedną ze ścian naczynia (pudełko).
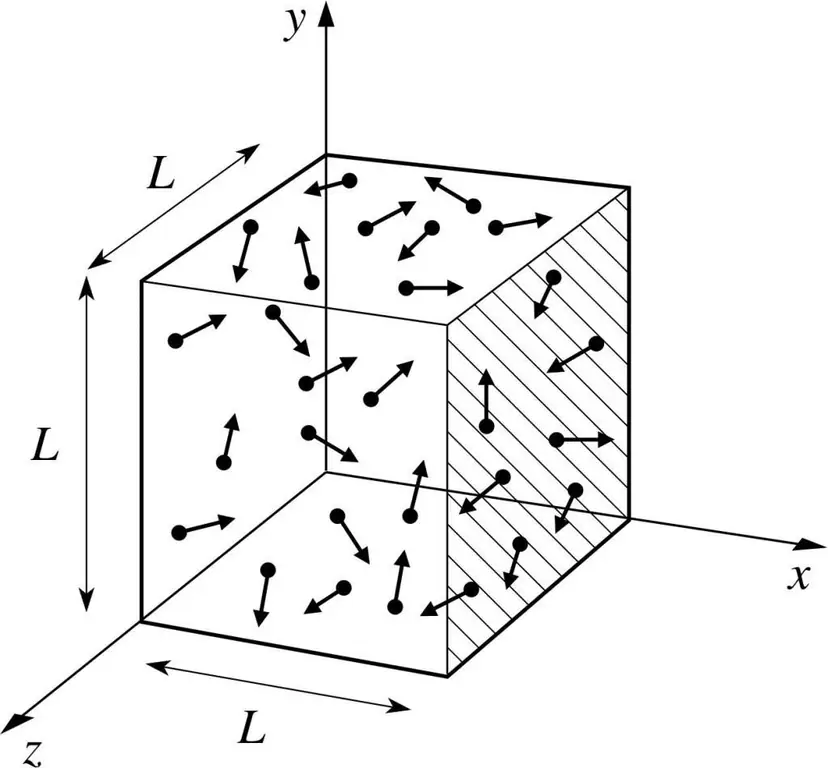
Pęd trwającego zderzenia, jak wiemy, jest określony wzorem: p=mv, ale w tym przypadku wzór ten przyjmie postać rzutowania: p=mv(x).
Ponieważ bierzemy pod uwagę tylko wymiar osi x, czyli oś x, całkowita zmiana pędu będzie wyrażona wzorem: mv(x) - m(-v(x))=2mv(x).
Następnie rozważ siłę wywieraną przez nasz obiekt, korzystając z drugiego prawa Newtona: F=ma=P/t.
Z tych wzorów wyrażamy ciśnienie od strony gazu: P=F/a;
Teraz podstawimy wyrażenie siły do otrzymanego wzoru i otrzymamy: P=mv(x)^2/L^3.
Następnie nasz gotowy wzór na ciśnienie można zapisać dla N-tej liczby cząsteczek gazu. Innymi słowy, będzie to wyglądać tak:
P=Nmv(x)^2/V, gdzie v to prędkość, a V to objętość.
Teraz spróbujmy podkreślić kilka podstawowych przepisów dotyczących ciśnienia gazu:
- Przejawia się poprzezzderzenia molekuł z molekułami ścian obiektu, w którym się znajduje.
- Wielkość ciśnienia jest wprost proporcjonalna do siły i szybkości uderzenia cząsteczek w ścianki naczynia.
Kilka krótkich wniosków z teorii
Zanim przejdziemy dalej i rozważymy podstawowe równanie molekularnej teorii kinetycznej, przedstawiamy kilka krótkich wniosków z powyższych punktów i teorii:
- Miarą średniej energii ruchu atomów i cząsteczek jest temperatura bezwzględna.
- Gdy dwa różne gazy mają tę samą temperaturę, ich cząsteczki mają tę samą średnią energię kinetyczną.
- Energia cząstek gazu jest wprost proporcjonalna do średniej prędkości kwadratowej: E=1/2mv^2.
- Chociaż cząsteczki gazu mają odpowiednio średnią energię kinetyczną i średnią prędkość, poszczególne cząsteczki poruszają się z różnymi prędkościami: niektóre szybko, inne wolno.
- Im wyższa temperatura, tym większa prędkość cząsteczek.
- Ile razy zwiększamy temperaturę gazu (na przykład dwukrotnie), energia ruchu jego cząstek wzrasta tyle razy (odpowiednio podwaja się).
Podstawowe równanie i wzory

Podstawowe równanie teorii kinetyki molekularnej pozwala ustalić związek między wielkościami mikroświata a, odpowiednio, wielkościami makroskopowymi, czyli zmierzonymi.
Jednym z najprostszych modeli, które może rozważyć teoria molekularna, jest model gazu doskonałego.
Można tak powiedziećjest to rodzaj urojonego modelu badanego przez molekularną teorię kinetyczną gazu doskonałego, w którym:
- Najprostsze cząsteczki gazu są uważane za doskonale sprężyste kulki, które oddziałują zarówno ze sobą, jak i z cząsteczkami ścian dowolnego naczynia tylko w jednym przypadku - zderzenie absolutnie elastyczne;
- siły przyciągania wewnątrz gazu są nieobecne lub można je właściwie pominąć;
- elementy wewnętrznej struktury gazu można traktować jako punkty materialne, to znaczy ich objętość również można pominąć.
Rozważając taki model, urodzony w Niemczech fizyk Rudolf Clausius napisał wzór na ciśnienie gazu poprzez zależność parametrów mikro- i makroskopowych. Wygląda to tak:
p=1/3m(0)nv^2.
Później ten wzór zostanie nazwany podstawowym równaniem molekularno-kinetycznej teorii gazu doskonałego. Może być prezentowany w kilku różnych formach. Naszym obowiązkiem jest teraz pokazanie takich działów, jak fizyka molekularna, teoria kinetyki molekularnej, a więc ich pełne równania i typy. Dlatego warto rozważyć inne odmiany podstawowej formuły.
Wiemy, że średnią energię charakteryzującą ruch cząsteczek gazu można znaleźć za pomocą wzoru: E=m(0)v^2/2.
W tym przypadku możemy zastąpić wyrażenie m(0)v^2 w pierwotnym wzorze na ciśnienie średnią energią kinetyczną. Dzięki temu będziemy mieli możliwość skomponowania podstawowego równania molekularnej teorii kinetycznej gazów w postaci: p=2/3nE.
Poza tym wszyscy wiemy, że wyrażenie m(0)n można zapisać jako iloczyn dwóch ilorazów:
m/NN/V=m/V=ρ.
Po tych manipulacjach możemy przepisać nasz wzór na równanie teorii molekularno-kinetycznej gazu doskonałego w trzeciej, innej postaci:
p=1/3ρv^2.
Cóż, może to wszystko, co musisz wiedzieć na ten temat. Pozostaje tylko usystematyzować zdobytą wiedzę w formie krótkich (a nie takich) wniosków.
Wszystkie ogólne wnioski i formuły na temat „Teoria molekularno-kinetyczna”
Więc zacznijmy.
Pierwsze:
Fizyka jest podstawową nauką objętą kursem nauk przyrodniczych, która bada właściwości materii i energii, ich strukturę, wzorce natury nieorganicznej.
Zawiera następujące sekcje:
- mechanika (kinematyka i dynamika);
- static;
- termodynamika;
- elektrodynamika;
- sekcja molekularna;
- optyka;
- fizyka kwantów i jądra atomowego.
Drugi:
Fizyka cząstek i termodynamika to ściśle powiązane dziedziny, które badają wyłącznie makroskopowy składnik całkowitej liczby układów fizycznych, to znaczy układy składające się z ogromnej liczby cząstek elementarnych.
Opierają się na teorii kinetyki molekularnej.
Po trzecie:
Sedno sprawy jest takie. Teoria kinetyki molekularnej opisuje szczegółowo strukturę substancji (częściej strukturę gazów niż ciał stałych).i ciała płynne), oparte na trzech fundamentalnych założeniach, które zostały zebrane z założeń wybitnych naukowców. Wśród nich: Robert Hooke, Isaac Newton, Daniel Bernoulli, Michaił Łomonosow i wielu innych.
Czwarte:
Trzy podstawowe założenia teorii kinetyki molekularnej:
- Wszystkie substancje (niezależnie od tego czy są płynne, stałe czy gazowe) mają złożoną strukturę składającą się z mniejszych cząsteczek: cząsteczek i atomów.
- Wszystkie te proste cząstki są w ciągłym, chaotycznym ruchu. Przykład: ruch i dyfuzja Browna.
- Wszystkie cząsteczki w każdych warunkach oddziałują ze sobą z pewnymi siłami, które mają elektryczną skałę.
Każdy z tych zapisów teorii kinetyki molekularnej jest solidnym fundamentem w badaniu struktury materii.
Piąte:
Kilka głównych punktów teorii molekularnej dla modelu gazu:
- Wszystkie gazy składają się z cząstek elementarnych, które nie mają określonego rozmiaru, ale mają określoną masę. Innymi słowy, objętość tych cząstek jest minimalna w porównaniu do odległości między nimi.
- Atomy i cząsteczki gazów praktycznie nie mają odpowiednio energii potencjalnej, ich całkowita energia jest równa energii kinetycznej.
- Z tą pozycją już zapoznaliśmy się wcześniej - ruchy Browna. Oznacza to, że cząsteczki gazu są zawsze w ciągłym i losowym ruchu.
- Absolutnie wszystkie wzajemne zderzenia atomów i cząsteczek gazów, którym towarzyszy przesłanie prędkości i energii, są całkowicie elastyczne. To jestoznacza, że podczas zderzenia nie ma utraty energii ani gwałtownych skoków ich energii kinetycznej.
- W normalnych warunkach i w stałej temperaturze średnia energia kinetyczna prawie wszystkich gazów jest taka sama.
Szóste:
Wnioski z teorii o gazach:
- Temperatura absolutna jest miarą średniej energii kinetycznej atomów i cząsteczek.
- Gdy dwa różne gazy mają tę samą temperaturę, ich cząsteczki mają tę samą średnią energię kinetyczną.
- Średnia energia kinetyczna cząstek gazu jest wprost proporcjonalna do średniej kwadratowej prędkości: E=1/2mv^2.
- Chociaż cząsteczki gazu mają odpowiednio średnią energię kinetyczną i średnią prędkość, poszczególne cząsteczki poruszają się z różnymi prędkościami: niektóre szybko, inne wolno.
- Im wyższa temperatura, tym większa prędkość cząsteczek.
- Ile razy zwiększamy temperaturę gazu (na przykład dwukrotnie), średnia energia kinetyczna jego cząstek również wzrasta tyle razy (odpowiednio podwaja się).
- Zależność między ciśnieniem gazu na ściankach naczynia, w którym się znajduje, a intensywnością uderzeń cząsteczek w te ściany jest wprost proporcjonalna: im więcej uderzeń, tym wyższe ciśnienie i odwrotnie.
Siódme:
Idealny model gazu to model, w którym muszą być spełnione następujące warunki:
- Cząsteczki gazu mogą i są uważane za doskonale elastyczne kulki.
- Te kulki mogą wchodzić w interakcje ze sobą i ze ścianami każdegostatek tylko w jednym przypadku - kolizja absolutnie elastyczna.
- Te siły, które opisują wzajemny napór między atomami i cząsteczkami gazu są nieobecne lub mogą być w rzeczywistości pominięte.
- Atomy i molekuły są uważane za punkty materialne, to znaczy, że ich objętość również może być pominięta.
Ósme:
Podajmy wszystkie podstawowe równania i pokażmy wzory w temacie "Teoria molekularno-kinetyczna":
p=1/3m(0)nv^2 - podstawowe równanie modelu gazu doskonałego wyprowadzone przez niemieckiego fizyka Rudolfa Clausiusa.
p=2/3nE - podstawowe równanie molekularno-kinetycznej teorii gazu doskonałego. Pochodzi ze średniej energii kinetycznej cząsteczek.
р=1/3ρv^2 - to samo równanie, ale uwzględniane przez gęstość i średnią kwadratową prędkość idealnych cząsteczek gazu.
m(0)=M/N(a) - wzór na wyznaczenie masy jednej cząsteczki przez liczbę Avogadro.
v^2=(v(1)+v(2)+v(3)+…)/N - wzór na obliczenie średniej kwadratowej prędkości cząsteczek, gdzie v(1), v(2), v (3) i tak dalej - prędkość pierwszej cząsteczki, drugiej, trzeciej i tak dalej aż do n-tej cząsteczki.
n=N/V - wzór na określenie stężenia cząsteczek, gdzie N jest liczbą cząsteczek w objętości gazu do danej objętości V.
E=mv^2/2=3/2kT - wzory na obliczanie średniej energii kinetycznej cząsteczek, gdzie v^2 jest pierwiastkiem średniej kwadratowej prędkości cząsteczek, k jest stałą wartość nazwana na cześć Austriaka fizyką Ludwiga Boltzmanna, a T to temperatura gazu.
p=nkT - wzór na ciśnienie w postaci stężenia, stałeBoltzmanna i temperatura bezwzględna T. Z tego wynika inny fundamentalny wzór, odkryty przez rosyjskiego naukowca Mendelejewa i francuskiego fizyka-inżyniera Claiperona:
pV=m/MRT, gdzie R=kN(a) jest uniwersalną stałą dla gazów.
Teraz pokażmy stałe dla różnych izoprocesów: izobaryczny, izochoryczny, izotermiczny i adiabatyczny.
pV/T=const - wykonywane, gdy masa i skład gazu są stałe.
рV=const - jeśli temperatura jest również stała.
V/T=const - jeśli ciśnienie gazu jest stałe.
p/T=const - jeśli głośność jest stała.
Być może to wszystko, co musisz wiedzieć na ten temat.
Dziś zanurzyliśmy się w takiej dziedzinie naukowej, jak fizyka teoretyczna, jej liczne sekcje i bloki. Bardziej szczegółowo poruszyliśmy taki obszar fizyki, jak fundamentalna fizyka molekularna i termodynamika, a mianowicie teoria molekularno-kinetyczna, która, jak się wydaje, nie przedstawia żadnych trudności w początkowych badaniach, ale w rzeczywistości ma wiele pułapek. Poszerza nasze zrozumienie modelu gazu doskonałego, który również szczegółowo zbadaliśmy. Ponadto warto zauważyć, że zapoznaliśmy się również z podstawowymi równaniami teorii molekularnej w ich różnych odmianach, a także rozważyliśmy wszystkie najpotrzebniejsze wzory do znalezienia pewnych nieznanych wielkości na ten temat. Będzie to szczególnie przydatne podczas przygotowywania się do pisania wszelkie testy, egzaminy i testy lub poszerzyć ogólne spojrzenie i wiedzę z zakresu fizyki.
Mamy nadzieję, że ten artykuł był dla Ciebie przydatny i że wydobyłeś z niego tylko najbardziej potrzebne informacje, wzmacniając swoją wiedzę w takich filarach termodynamiki, jak podstawowe założenia molekularnej teorii kinetycznej.






